Anticoagulare în insuficiența renală
rezumat
Anticoagularea este dificilă la pacienții cu insuficiență renală din cauza funcției trombocitare afectate și a eliminării renale a unor anticoagulante. Utilizarea heparinei și cumarinelor nefracționate necesită o monitorizare regulată prin teste de coagulare adecvate, deși nu este necesară o ajustare a dozei lor. Tratamentul a mai mult de trei zile cu heparine cu greutate moleculară mică la pacienții cu clearance-ul creatininei 30 ml/min necesită o reducere a dozei lor la jumătate și o doză de activitate anti-Xa la fiecare 48 până la 72 de ore. Utilizarea inhibitorilor de trombină directă și danaparoidă trebuie rezervată pacienților cu trombocitopenie indusă de heparină și sub supravegherea regulată a testelor de coagulare corespunzătoare.
Introducere
Imaginile dramatice ale pericarditei uremice, adesea hemoragice, devin din ce în ce mai rare odată cu inițierea precoce a dializei cronice. Cu toate acestea, acești pacienți prezintă frecvent o tendință crescută la vânătăi (mai rar la epistaxis și gingivoragie), precum și un risc crescut de sângerare digestivă, cerebrală sau în timpul procedurilor invazive.
Paradoxal, pacienții cu hemodializă de lungă durată prezintă, de asemenea, o stare hipercoagulabilă a cărei etiologie este multifactorială (activarea factorilor de coagulare de către materialele extracorporale necesare dializei, prezența anticorpilor antifosfolipidici, deficiența antitrombinei în caz de sindrom nefrotic concomitent), care poate pune în pericol viabilitatea fistulelor și a protezelor vasculare.
Există multe indicații pentru anticoagulare la pacienții cu insuficiență renală din cauza prevalenței ridicate a bolilor cardiovasculare, a complicațiilor trombotice, în special în sindromul nefrotic, dar și în raport cu diferitele accesuri vasculare necesare pentru hemodializă sau circuite. Extracorporeal. Aproximativ 10% dintre pacienții cu hemodializă cronică din Statele Unite primesc anticoagulare permanentă. 2 Gestionarea anticoagulării profilactice sau terapeutice este dificilă la pacienții cu CRF, datorită tendinței lor la diateza hemoragică și eliminarea renală a anumitor anticoagulante.
Această revizuire discută caracteristicile utilizării principalelor anticoagulante la pacienții cu BCR și hemodializă. Problema anticoagulării la pacienții cu ARI în medii de terapie intensivă va fi discutată doar pe scurt în această revizuire. În special, anticoagularea regională a citratului utilizată din ce în ce mai frecvent în timpul hemofiltrării continue la pacienții cu risc crescut de sângerare nu va fi discutată aici.
Antivitaminele K
Derivații sintetici de cumarină, acenocumarolul (Sintrom ®) și fenprocumona (Marcoumar ®) sunt principalele anticoagulante orale utilizate în Elveția. AVK-urile (antivitaminele K) inhibă gama-carboxilarea anumitor factori de coagulare (factorii II, VII, IX și X dar și proteinele C și S), ducând la producerea unor factori inactivi numiți PIVKA (Proteina indusă de antagonistul vitaminei K). La începutul tratamentului, VKA exercită în mod paradoxal un efect procoagulant discret, în special datorită scăderii foarte rapide a proteinei C, care este un inhibitor al coagulării cu un timp de înjumătățire foarte scurt.
AVK sunt metabolizate în ficat și excretate într-o formă inactivă în scaun și urină. Nu este necesară ajustarea dozei în insuficiența renală. Cu toate acestea, AVK-urile se leagă de proteinele plasmatice, în principal de albumină. Pacienții cu CRF au adesea hipoalbuminemie, ceea ce duce la o creștere a fracției libere și, prin urmare, la un efect anticoagulant mai accentuat al VKA la acești pacienți. 3
Heparini
Trebuie să distingem în principal două tipuri de heparine, heparine nefracționate (UFH, Liquémine ® și Calciparine ® disponibile pe piața elvețiană) și heparine cu greutate moleculară mică (heparină cu greutate moleculară mică (LMWH), Clexane ®, Fraxiparine ®, Fraxiforte ® și Fragmin ® disponibil în Elveția).
Fondaparinux (Arixtra ®), nou introdus în Elveția, este o pentazaharidă sintetică. Este, de fapt, cea mai mică structură din heparină capabilă să se lege de antitrombină. Provoacă inhibarea selectivă a factorului Xa. Acest medicament nu trebuie utilizat la pacienții cu IRC severă și trebuie utilizat cu mare precauție la pacienții cu IRC moderată, datorită timpului de înjumătățire relativ lung și eliminării sale exclusiv renale sub formă nemodificată. 13
Heparina este utilizată în aceleași indicații ca VKA, dar sunt prescrise la începutul tratamentului, având în vedere debutul rapid al acțiunii. FNH este utilizat pentru prevenirea trombozei circuitelor extracorporale în timpul sesiunii de hemodializă, deși LMWH-urile îl înlocuiesc în prezent din ce în ce mai mult în această indicație. Deși LMWH-urile nu sunt dializate, utilizarea lor în această indicație pare a fi la fel de sigură ca cea a UFH. 14 În mediile de terapie intensivă, acestea au fost utilizate și cu satisfacție la pacienții tratați cu hemofiltrare continuă. 15 Cu toate acestea, neutralizarea mai slabă a efectului lor anticoagulant de către sulfatul de protamină îngreunează utilizarea acestora la pacienții cu risc crescut de hemoragie.
Danaparoid sodic
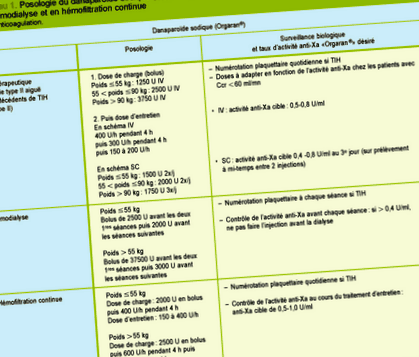
Sodiu Danaparoid (Orgaran®) este un amestec de glicozaminoglicanii cu greutate moleculară mică (heparansulfat, dermatan-sulfat, condroitin-sulfat). La fel ca heparinele, are nevoie de un cofactor, antitrombina, pentru a acționa, dar prezintă o activitate anti-Xa mult mai selectivă decât LMWH-urile. Este utilizat în principal în cazuri de TIH sau în antecedente de TIH, deși au fost descrise reacții încrucișate (110%). 16 Măsurarea activității sale se efectuează, ca și în cazul LMWH-urilor, prin măsurarea activității anti-Xa, dar cu o curbă specifică într-un laborator specializat. Datorită perioadei sale de înjumătățire lungă (aproximativ 25 de ore) și a eliminării sale predominant renale, ajustarea dozelor este necesară în insuficiența renală și nu se recomandă utilizarea acesteia în cazul CRF sever. De asemenea, utilizat ca anticoagulant în hemodializă și în hemodiafiltrare continuă, în special la pacienții cu TIH, efectul său cumulativ implică o monitorizare extrem de regulată a activității anti-Xa (Tabelul I). Nu există un antidot specific și, în caz de sângerare, poate fi justificată administrarea plasmelor proaspete congelate sau chiar a factorului VIIa.
Inhibitori direcți ai trombinei
Inhibitorii direcți ai trombinei îi inhibă pe aceștia din urmă prin legarea la situsul său activ și/sau la unul dintre exosite. Spre deosebire de heparină, acestea se leagă direct de trombină, independent de antitrombină sau de alți cofactori și sunt capabili să acționeze atât asupra trombinei în forma sa liberă, cât și direct la nivelul cheagului. 17 Pot fi clasificate în două categorii. Forma univalentă se leagă numai de situl catalitic (activ) al trombinei (argatroban și melagatran care sunt forma activă a ximelagatran). Forma bivalentă se leagă atât la locul catalitic, cât și printr-o legătură carboxilică la exositul 1, sporind astfel afinitatea acesteia (hirudine: desirudină, lepirudină și bivalirudină). Structura lor chimică fiind total diferită de cea a heparinelor, nu există o reactivitate încrucișată în cazul HIT.
Hirudins
Hirudin este o mică peptidă naturală extrasă din glandele salivare ale lipitorilor medicinali. Timpul său de înjumătățire este scurt, iar eliminarea are loc prin rinichi, necesitând o ajustare a dozei în caz de insuficiență renală. Două forme recombinante (r-hirudin) sunt disponibile în Elveția: lepirudin (Refludan ®) și desirudin (Revasc ®).
Lepirudina este utilizată în principal în tratamentul TIH. Monitorizarea se poate face prin măsurarea aPTT (x 1,5-3 aPTT de bază) și a timpului ecarin (ECT). Cu toate acestea, activitatea cromogenică anti-IIa oferă o indicație mai bună a concentrației plasmatice. Se recomandă controlul zilnic al carcasei, deoarece pot apărea variații, în special după a cincea zi de utilizare, datorită apariției anticorpilor antihirudin care, prin formarea complexelor de anticorpi hirudin-antihirudin, interferează cu clearance-ul renal și întârzie eliminarea acestuia din plasmă, necesitând o reducerea dozelor administrate. 18 Dozele recomandate (vezi Compendiul elvețian de medicamente) sunt prea mari (explicând în mare măsură complicațiile hemoragice descrise cu această substanță) și trebuie reduse, mai ales în cazuri de insuficiență renală chiar moderată (Tabelul 2) pentru a obține un anti-cromogen Activitatea IIa între 0,25 și 1,25 mg/ml. Rețineți că, având în vedere riscul de reacții alergice care ar părea a fi mai mare (șoc anafilactic) în timpul administrării inițiale a unui bolus, acesta din urmă trebuie prescris numai în prezența trombozei.
La pacienții care fac hemodializă și pentru a evita coagularea circuitului extracorporeal, doza recomandată de obicei în literatură este un bolus de 0,15 mg/kg care trebuie administrat la începutul ședinței. 19 Prezența sau absența funcției renale reziduale poate face ca nivelul plasmatic al lepirudinei să varieze între ședințe, ceea ce poate duce la un efect cumulativ. Cu toate acestea, o revizuire a literaturii sugerează că această doză pare a fi prea mare și poate duce la supraanticoagulare. 19.20
Există o experiență limitată cu lepirudină în timpul hemofiltrării continue. Studiile rare care au comparat lepirudina cu heparina nu au putut demonstra o superioritate clară a unei substanțe în ceea ce privește eficacitatea anticoagulantă și efectele secundare. Absența unui antagonist al lepirudinei ar încuraja într-un cadru de terapie intensivă să își rezerve indicația pentru pacienții cu HIT.
Cu o greutate moleculară și o structură foarte asemănătoare, desirudina pe cale subcutanată poate fi utilizată în prevenirea trombozei venoase profunde în chirurgia ortopedică (proteză de șold și genunchi), unde eficacitatea sa este mai mare decât UFH și LMWH în scăderea incidenței de tromboză venoasă profundă diagnosticată prin venografie. 21 Deoarece eliminarea acestuia este și renală, doza trebuie ajustată la pacienții cu insuficiență renală.
Bivalirudina (nu este disponibilă în Elveția) a fost aprobată de FDA ca anticoagulant care trebuie administrat în asociere cu aspirină, la pacienții cu angină pectorală instabilă și care suferă angioplastie coronariană percutană (PTCA). Are avantajul legării reversibile la trombină și un timp de înjumătățire mai scurt. 22
Argatroban și ximelagatran (melagatran)
Un derivat sintetic al argininei, argatrobanul (produsul nu este disponibil în Elveția) este metabolizat de ficat și excretat în principal prin bilă, cu toate acestea în jur de 16% este excretat în urină în forma sa primară. Timpul său de înjumătățire este foarte scurt și poate fi utilizat numai intravenos. Trebuie utilizat cu precauție la pacienții cu insuficiență hepatică, nu este necesară ajustarea dozei în insuficiența renală. Există puține date despre utilizarea sa la pacienții cu hemodializă sau care sunt supuși hemofiltrării continue. Un studiu a arătat că utilizarea argatrobanului a împiedicat în mod satisfăcător coagularea circuitului extracorporeal în timpul ședințelor de hemodializă fără complicații sângerante. 23
Ximelagatran este o moleculă lipofilă care este bine absorbită de tractul digestiv și transformată rapid în forma sa activă, melagatran, care se leagă de locul catalitic al trombinei. 24 Timpul său de înjumătățire este scurt și eliminarea acestuia se produce prin rinichi sub formă nemodificată, contraindicând utilizarea acestuia la pacienții cu un Ccr l 30 ml/min. Experiența în hemodializă și hemofiltrare continuă este foarte limitată cu ximelagatran. Deși această moleculă este extrem de interesantă, utilizarea sa este acceptată în prezent doar pentru o perioadă limitată la zece zile, din cauza unei incidențe ridicate de hepatotoxicitate. 25
Concluzie
Pe scurt, pacienții cu CRF, în special atunci când Ccr au mai puțin de 30 ml/min, prezintă un risc crescut de sângerare. Utilizarea cumarinei și UFH nu necesită nicio adaptare specială în caz de insuficiență renală, dar controalele frecvente sunt imperative. În afară de prevenirea trombozei circuitului extracorporeal în hemodializă, LMWH-urile trebuie utilizate cu precauție în insuficiența renală și tratamentul mai mult de trei zile cu LMWH la pacienții cu Ccr l 30 ml/min necesită o reducere cu 50% a dozelor sau a frecvenței administrarea și monitorizarea activității anti-Xa. Lepirudina și danaparoidul sodic trebuie prescrise numai la pacienții cu insuficiență renală în cazurile de HIT. Deoarece experiența cu alți inhibitori de trombină este limitată în prezent, aceștia trebuie utilizați numai în studiile clinice.
Bibliografie
- Deficitul de fier, anemia inflamatorie sau mixtă cum se ghidează diagnosticul Swiss Medical Review
- Beneficiile controlului anticoagulării orale de către INR capilar - Swiss Medical Journal
- Abordări terapeutice pentru gută în 2006 - Swiss Medical Review
- Tulburări pulmonare și altitudine - Swiss Medical Review
- Aritmii atriale, mecanism, prezentare ECG și tratament curativ - Swiss Medical Review