Noi terapii pentru bolile osoase ale copilăriei
rezumat
Tratamentul bolilor osoase din copilărie a făcut progrese semnificative în ultimii ani. Progresele în cunoașterea științifică a fiziopatologiei bolilor genetice osoase au permis dezvoltarea unor terapii eficiente de înlocuire a enzimelor pentru diferite boli lizozomale, cum ar fi boala Gaucher. Studiile clinice au început, de asemenea, cu molecule care corectează fragilitatea osoasă, durerea cronică și alte manifestări de hipofosfatazie sau defecte de creștere osoasă lungă în acondroplazie. Raportăm, de asemenea, experiența noastră încurajatoare de tratament intravenos cu bifosfonați la copiii care suferă de osteopenie secundară și prevalența ridicată a deficiențelor de calciu și vitamina D constatate la acești copii cu dizabilități multiple.
Introducere
Bolile osoase din copilărie sunt un grup eterogen de boli care afectează structura, dezvoltarea și creșterea scheletului. Pot fi primare (displazie osoasă genetică) sau secundare altor boli cronice, tratamente medicamentoase sau deficiențe nutriționale. Acest articol prezintă tratamentele specifice dezvoltate recent pentru mai multe boli genetice genetice primare considerate anterior incurabile și noile tratamente în domeniul osteopeniei secundare.
Boli de suprasarcină lizozomală cu afectare osoasă: terapie de substituție enzimatică (EST)
Un număr tot mai mare de boli lizozomale beneficiază acum de terapia enzimatică specifică. Această formă de terapie a fost dezvoltată grație înțelegerii bazei moleculare a acestor boli și a mecanismelor de livrare intracelulară a enzimelor către lizozomi după sinteza lor.
Primul tratament enzimatic specific a fost dezvoltat pentru boala Gaucher; Acumularea de glucocerebrosid în macrofagele de organe (ficat, splină, schelet) este contracarată de perfuzii intravenoase săptămânale de glucocerebrosidază. Tratamentul neîntrerupt menține aceste organe sănătoase. 1 Enzima, produsă de ingineria genetică în cultura celulară, este modificată prin adăugarea unei peptide recunoscute de receptorii lizozomali pentru a intra în aceste organite unde degradează mai multe macromolecule structurale.
Aceeași strategie a fost folosită cu succes pentru a crea alte câteva TES care vizează lizozomii. Aceste tratamente sunt foarte eficiente împotriva manifestărilor viscerale și osoase ale acestor boli, deși pentru implicarea osoasă sunt deseori necesare doze mai mari de TES. 2 Pe de altă parte, bolile ale căror manifestări sunt în principal cerebrale nu sunt îmbunătățite prin aceste tratamente, deoarece enzimele date prin perfuzie nu intră în general în sistemul nervos central. 3
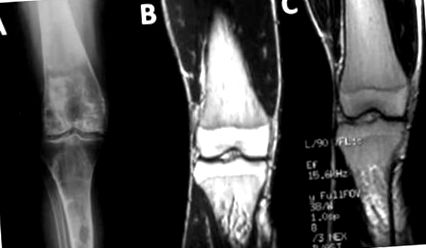
În bolile lizozomale, se observă deformări ale tuturor elementelor osoase (disostoză multiplexă), dar și o reducere a mobilității articulațiilor și a densității osoase. În boala Gaucher, osul este predispus la infarcturi ale măduvei osoase, manifestându-se ca atacuri extrem de dureroase și rezultând osteonecroză (Figura 1). Bolile lizozomale cu afectare osoasă, pentru care este disponibil TES sau în faza de studiu clinic, sunt rezumate în Tabelul 1.
Necroză femurală și tibială la un pacient adult cu atacuri dureroase acute. B. RMN al membrelor inferioare la un băiat de cincisprezece ani cu boală Gaucher: necroză a tibiei drepte manifestată cu durere cronică severă și progresivă. VS. RMN al membrelor inferioare la același băiat din figura B, după șase luni de TES (terapia de substituție enzimatică) la doza maximă (60 U/kg/2 săptămâni), există o reducere a leziunilor, însoțită clinic de remisiunea durerii.
Boli de suprasarcină lizozomală cu afectare osoasă și terapia lor de substituție enzimatică (EST) disponibile pe piață
Hipofosfatazie: terapie de substituție enzimatică
TES a fost mult timp limitat la enzimele adresate sistemului reticulo-endotelial și la lizozomi. Recent, cercetările s-au extins în alte tipuri de enzime a căror activitate nu este limitată la organele celulare specifice.
Hipofosfatazia (HPP) este cauzată de mutații recesive în gena ALP, care codifică fosfataza alcalină nespecifică țesutul. 4 Spectrul fenotipic este larg, variind de la forme letale ale fetușilor „fără os” la forme ușoare cu întârziere a creșterii și dureri osoase, sau chiar limitat la pierderea prematură a dinților. Tabelele intermediare includ diferite grade de dimensiuni mici cu displazie metafizară și pot fi confundate cu rahitismul. Au fragilitate osoasă și dificultăți în consolidarea fracturilor. Majoritatea pacienților au dureri osoase cronice și pot prezenta complicații articulare, cum ar fi periartrita calcificată și calcificările ectopice. PPH este o boală în principal a oaselor, cu consecințe sistemice inconsistente, cum ar fi hipercalcemia, hipercalciuria, hiperfosfatemia sau nefrocalcinoza. Tulburările metabolismului calciului pot afecta mușchiul (dureri musculare cronice, slăbiciune), precum și sistemul nervos (convulsii). PPH este o boală progresivă; atunci când sunt diagnosticați la vârsta adultă, simptome semnificative apar retrospectiv din copilărie.
Principalul biomarker al bolii este nivelul fosfatazei alcaline din sânge (ALP), care este redus la toți pacienții. Alți biomarkeri sunt substraturi naturale ale enzimei, care se găsesc crescute în plasmă și urină datorită persistenței formei lor fosforilate (fosfoetanolamină, piridoxal-fosfat). Diagnosticul este confirmat de analiza moleculară a genei ALP.
Terapia de substituție a enzimei HPP (ENB-0040) a fost concepută pentru a furniza fosfatază alcalină în os, minimizând efectele secundare sistemice. ENB-0040 este o moleculă de fuziune între enzimă și porțiunea Fc a IgG umană legată de o peptidă derivată din osteopontină și sialoproteină osoasă, două proteine direcționate în mod natural pentru a intra în țesutul osos. La șoarecele Akp2 -/-, un model de PPH umană severă din copilărie, acest tratament a fost eficient împotriva simptomelor osoase și neurologice. 5,6 Un studiu clinic de fază IIb este în desfășurare pe 70 de pacienți, cu rezultate preliminare foarte încurajatoare în ceea ce privește eficacitatea și siguranța: astfel, la mai mulți copii cu forme infantile de hipofosfatazie, progresia bolii ar putea fi oprită nu numai, ci mineralizarea s-a îmbunătățit cu un efect pozitiv asupra supraviețuirii și dezvoltării motorii a copiilor.
Acondroplazie
Patogeneza acondroplaziei este complexă: 8 FGFR3 este implicat în controlul proliferării condrocitelor în cartilajul de creștere; mutația achondroplakiei conferă o activitate constitutivă exagerată asupra receptorului FGFR3, ceea ce determină diferențierea condrocitelor prea devreme, ducând la o creștere redusă a oaselor lungi. Una dintre căile de reglare pozitive pentru creșterea osoasă este ghidată de peptida natriuretică C (CNP) care se leagă de receptorul său specific și induce o cascadă de semnale intracelulare în celulele cartilajului de creștere prin inhibarea căii FGFR3. Efectul benefic al activării CNP asupra creșterii prin antagonismul căii FGFR39 a fost verificat la șoareci prin administrarea de CNP (BMN-111) (www.bmrn.com/ pipeline/cnp-for-achondroplasia. Php). Administrarea zilnică subcutanată de BMN-111 corectează nanismul, permițând o bună creștere a oaselor lungi. Un studiu clinic de fază I a început în Statele Unite. Acest tratament poate fi, de asemenea, eficient pentru alte displazii genetice ale membrelor scurte, în care reglarea semnalelor moleculare ale creșterii osoase lungi este perturbată.
Osteopenie primară și secundară
Osteopenia copilăriei se manifestă prin fragilitatea osoasă (fracturi după un traumatism minor), dureri osoase cronice și densitate osoasă cu un scor Z sub -2 abateri standard. Osteopenia copilăriei poate fi primară (de exemplu osteogenesis imperfecta) sau secundară altor boli cronice, genetice sau dobândite (miopatii congenitale, handicap multiplu, terapie prelungită cu steroizi etc.). Măsurile terapeutice generale, cum ar fi aportul adecvat de calciu și vitamina D sau prevenirea imobilizării prelungite și a supraponderabilității sunt adesea insuficiente; durerea cronică poate deveni o problemă majoră pentru calitatea vieții copiilor osteopenici (tulburări de somn, depresie, absenteism școlar, refuzul mobilizării, utilizarea continuă a analgezicelor și a efectelor secundare ale acestora).
Managementul osteopeniei a făcut progrese considerabile de la introducerea terapiei cu bifosfonați. Aceste medicamente inhibă activitatea osteoclastelor favorizând depunerea osoasă peste resorbție. Deoarece absorbția intestinală este scăzută (11-13 La copiii cu distrofie musculară Duchenne, s-a documentat și o îmbunătățire a supraviețuirii. 14 Pamidronatul este bifosfonatul cel mai des utilizat în pediatrie conform protocolului de la Montreal, dezvoltat inițial pentru Osteogenesis imperfecta 15. trei perfuzii la 1 mg/kg/doză timp de trei zile consecutive la fiecare patru luni la copii cu vârsta peste trei ani Durata totală a tratamentului este evaluată individual pe baza răspunsului clinic și radiologic; de obicei durează doi ani pentru a obține densitatea osoasă care reduce semnificativ riscul de fractură.
În ultimii zece ani, echipa noastră a administrat bifosfonați copiilor cu osteogeneză imperfectă (figura 2) și, mai recent, copiilor cu osteopenie secundară. Grupul nostru de pacienți este descris în Tabelul 2, care arată efectul tratamentului asupra densității osoase, dar mai important, asupra fracturilor și durerii osoase cronice. Aceste date, chiar dacă sunt colectate retrospectiv și în afara cadrului unui studiu clinic, reflectă totuși valoarea acestui tratament și sunt singurele date disponibile cu privire la copiii tratați în Elveția. Pe baza experienței noastre, păstrăm ca indicație pentru tratamentul cu bifosfonați intravenoși copii cu cel puțin două dintre următoarele criterii: densitate osoasă mai mică de -2 SD și/sau fracturi multiple (cel puțin două) la traumatisme minore și/sau durere osoasă cronică . Toți au fost tratați cu pamidronat (cu excepția unuia sau a doi pacienți care au început cu clodronat și au continuat cu pamidronat).
LA. Fractura arborelui patologic în traumatisme minore la vârsta de trei ani. B. Același femur după un an de terapie cu pamidronat IV: structura osoasă este mai compactă și forma femurului mai dreaptă. Striaturile metafizare regulate mărturisesc calcificarea indusă de bifosfonați, dată la intervale regulate și urmată de faze de creștere.
Copii cu osteopenie primară și secundară, tratați cu bifosfonați intravenoși la CHUV, pediatrie moleculară
> Osteopenia secundară în copilărie este, de asemenea, o indicație pentru tratamentul cu bifosfonați, care îmbunătățește calitatea vieții pacienților
> Costurile acestor tratamente sunt foarte mari și necesită ca indicația și urmărirea să fie efectuate de către un specialist
Bibliografie
Abstract
S-au realizat progrese considerabile în ultimii ani în tratarea copiilor afectați de boli osoase. Progresele în înțelegerea fiziopatologiei moleculare a bolilor genetice osoase au condus la dezvoltarea unor terapii de înlocuire a enzimelor pentru diferite boli de depozitare lizozomală, după descoperirea inițiată în tratarea bolii Gaucher. Sunt în curs studii clinice cu molecule adaptate care corectează fragilitatea osoasă și ameliorează durerile osoase cronice și alte manifestări ale hipofosfataziei sau promovează creșterea oaselor lungi la pacienții cu acondroplazie. Raportăm în continuare experiența noastră încurajatoare cu tratamentul cu bifosfonați intravenoși la copiii care suferă de osteopenie secundară și prevalența ridicată a deficitelor de calciu și vitamina D la acești copii cu handicap sever.
- Boli care imită l; astm sau boală pulmonară obstructivă cronică - Swiss Medical Review
- Mișcări anormale în camera de urgență - Swiss Medical Review
- Obezitate și inegalități, o fotografie a Franței astăzi - Swiss Medical Review
- Neurologie - Revista medicală elvețiană
- Pediatrie - Swiss Medical Journal