Structură separare macromoleculă acid amină electroforeză tutoriale Predare și
1. Un amestec din următorii aminoacizi este supus electroforezei hârtiei la pH 3,9: A, S, F, L, R, D, H. Care aminoacizi migrează către anod? Care aminoacizi migrează către catod ?
2. De ce aminoacizii cu aceeași sarcină se separă foarte ușor în timpul electroforezei (exemplu: Gly vs. Leu) ?
3. Luați în considerare amestecul de aminoacizi A, V, E, K, T la pH 6. Care este profilul de migrație după electroforeză pe hârtie? Indicați locația depozitului, a anodului, a catodului și a oricărui aminoacizi nedespărțiți. Care produs ajută la dezvăluirea aminoacizilor ?
Principiul și utilizarea electroforezei
Scopul electroforezei este de a separa moleculele încărcate printr-un gel (un polimer) sub efectul unui câmp electric .
Moleculele se deplasează spre polul de sarcină opus sarcinii lor nete z, la o viteză v proporțională cu această sarcină: v = E. z/f
- E este puterea câmpului electric
- f este forța de frecare
Prin urmare, separarea electroforetică se face în funcție de raportul [sarcină/masă] .
Mobilitatea electroforetică a unei molecule poate fi exprimată (într-un mod simplificat) prin relația: mobilitate = k. (pH - pI)/masa molară
unde pI este punctul izoelectric al moleculei.
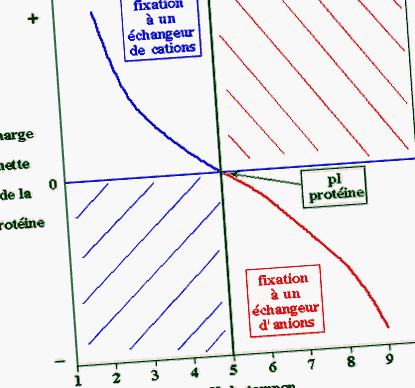
Luați în considerare o proteină de pI = 5:
- dacă pH-ul tamponului utilizat pentru cromatografie este mai mic decât pI al proteinei (zona albastră - figura de mai jos), acesta din urmă este încărcat pozitiv: trebuie utilizat un schimbător de cationi
- dacă pH-ul tamponului utilizat pentru cromatografie este mai mare decât pI al proteinei (zona roșie), acesta din urmă este încărcat negativ: trebuie utilizat un schimbător de anioni.
Electroforeza permite, printre altele, să:
| Întrebarea 1. În cazul amestecului de aminoacizi (A, S, F, L, R, D, H.) supus electroforezei hârtiei la pH 3,9: |
| Amino acid | pI | încărcare la pH 3,9 | direcția de migrare |
| LA | 6 | + | catod |
| S | 5.7 | + | catod |
| F | 5.5 | + | catod |
| L | 6 | + | catod |
| R | 10.8 | +++ | catod |
| D | 2.9 | - | anod |
| H | 7.6 | ++ | catod |
| Notă: în funcție de sursă, valorile pI sau pKa diferă ușor. | |||
| Întrebarea 3. Profilul de separare electroforetic al amestecului: A, V, E, K, T la pH 6. |
| Amino acid | pI | încărcare la pH 6 | direcția de migrare |
| LA | 6 | neutru | nu migrați |
| V | 6 | neutru | nu migrați |
| E | 3.2 | negativ | anod |
| K | 9.6 | pozitiv | catod |
| T | 5.6 | ușor negativ | migrație ușoară a anodului |