Medicină: studiile clinice nu sunt publicate niciodată din motive inevitabile
Celine Deluzarche
Jurnalist
Publicat la 29.09.2018
Publicat la 29.09.2018
Deși este obligatoriu din 2012, jumătate din studiile clinice efectuate în Europa nu fac obiectul niciunei publicări oficiale a rezultatelor lor. Dacă laboratoarele mari sunt studenți buni, instituțiile publice păcătuiesc prin lipsa lor de rigoare și uneori susțin scuze suprarealiste. Această lipsă de transparență este în orice caz dăunătoare cercetării științifice.
Sute de studii clinice sunt efectuate în fiecare an în Europa. Scopul acestuia din urmă este de a evalua eficacitatea unei noi așa-numite legături covalente simple. "data-image =" https://cdn.futura-sciences.com/buildsv6/images/midioriginal/d/0/e/d0e3dc7e1e_76472_molecule.jpg "data-url ="/sciences/definition/chimie-molecule-783/"data-more =" Citește mai mult "> moleculă sau tratament, pentru a-i verifica efectele secundare și siguranța. Acesta este ultimul pas esențial în comercializarea unui viitor medicament sau protocol de tratament. 2004 în Europa, fiecare studiu clinic trebuie înregistrat într-un registru EUCTR (registrul studiilor clinice ale Uniunii Europene), administrat de Agenția Europeană a Medicamentului (EMA). Și în urma unei directive din 2012, toate rezultatele lor, pozitive sau negative, trebuie publicate în termen de 12 luni.
Realitatea este că aproape jumătate (49%) din procese încalcă regula, așa cum a fost dezvăluit într-un studiu publicat pe 12 septembrie în revista BMJ. Autorul său principal, Ben Goldacre, cunoaște bine subiectul, deoarece conduce medicamentul bazat pe dovezi DataLab (EBM DataLab), un laborator de cercetare de la Universitatea din Oxford, care analizează date despre prescripții, studii clinice sau retractări științifice. În 2018, acesta din urmă a lansat site-ul EU Trials Tracker, care listează rata de publicare a rezultatelor studiilor clinice în Europa.
Laboratoarele mari sunt cele mai virtuoase
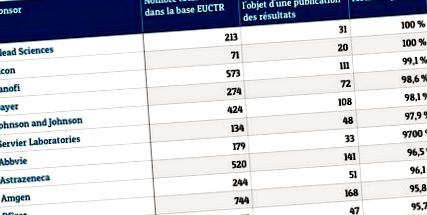
Pentru studiul său BMJ, Ben Goldacre și șase dintre colegii săi au identificat 31.821 de studii clinice înregistrate în baza de date EUCTR din 2004 și i-au exclus pe cei care nu îndeplineau criteriile valabile de publicare (studii nefinalizate, data sau țara lipsă). În cele din urmă, 7.274 de teste au fost selectate în cele din urmă. Dintre acestea, abia 3.601 au fost publicate, sau 49,5%. Studiul a încercat, de asemenea, să stabilească o clasificare după tipul de sponsor (organismul care finanțează procesul).
Laboratoarele private mari, precum Alcon, Sanofi, Bayer, Novartis, Servier sau Pfizer, au rate de conformitate de peste 95%. În partea de jos a clasamentului, Spitalele din Paris nu au publicat niciunul dintre rezultatele a șapte studii pe care ar fi trebuit să le raporteze, la fel ca Hospices Civils de Lyon sau Universitatea din München. Ca regulă generală, testele efectuate de un laborator sau o entitate comercială fac obiectul a 68,1% din publicații, în timp ce cele organizate de instituții necomerciale (universități, spitale, organizații publice de cercetare) sunt mult mai puțin riguroase, cu o rată de publicare de abia 11%.
Studii clinice: laboratoare cu o rată de conformitate mai mare de 95% (selecție). Sursa: Ben Goldacre și colab., BMJ, 2018
În afară de nepublicarea rezultatelor, cercetătorii evidențiază și numeroasele „erori, omisiuni și neconcordanțe” din registru. 29,4% din studiile marcate ca finalizate nu au o dată de încheiere, în timp ce altele menționează o dată de încheiere în timp ce sunt încă în desfășurare în unele țări.
Cum să explic un astfel de fiasco? Se pare că acest lucru nu este din dorința de a ascunde concluzii care nu s-ar potrivi laboratoarelor (de exemplu, demonstrând ineficiența unei molecule), deoarece acestea din urmă, dimpotrivă, prezintă rate de conformitate aproape de 100%. Deoarece lipsa de rigoare este observată în special la sponsorii mici (cei care efectuează puține teste), poate fi o lipsă de cunoaștere a procedurilor sau diluarea responsabilităților. „Din punct de vedere legal, instituția care finanțează studiul trebuie să publice rezultatele în baza de date EUCTR, dar în universități, această sarcină este deseori delegată medicilor care au efectuat studiul în domeniu”, explică Ben, în special. Goldacre. O altă problemă este că cei care au supravegheat studii care datează de câțiva ani (între 2004 și 2012) s-au retras uneori sau și-au schimbat locul de muncă. Este dificil să găsești rezultatele pentru a le include în registru.
Dar unele scuze invocate de vinovați sunt uluitoare. „Studii efectuate în urmă cu 10 ani, care nu mai interesează pe nimeni”, spune una dintre persoanele intervievate de cercetători. „Nu sunt plătit pentru timpul petrecut raportând rezultatele”, s-a plâns un altul. Autorii au avut chiar dreptul la „Rezultatele negative postate nu sunt bune pentru cariera mea” sau „Acesta este studiul MEU și, prin urmare, rezultatele MELE sunt ale mele”.
Studii clinice: instituții care nu au raportat niciun rezultat (selecție). Sursa: Ben Goldacre și colab., BMJ, 2018
Impunitate totală
Lipsa de timp menționată adesea pare destul de înșelătoare. Pentru că, dacă medicii sunt reticenți să-și publice rezultatele în registrul oficial, ei își găsesc timpul pentru a le prezenta în reviste științifice de prestigiu sau în conferințe. Autorii au extras astfel un eșantion de 100 de teste din baza de date EUCTR, ale căror rezultate lipsesc. Patruzeci și șase dintre ei fuseseră totuși subiectul unui articol într-o revistă științifică și cinci în „literatura gri” (rapoarte de studiu, pre-publicații, teze, lucrări de conferință). „Este îngrijorător să observăm că oamenii de știință preferă să își publice rezultatele în jurnale decât într-un registru oficial, ale cărui date pot fi verificate și unde rezultatele sunt formalizate”, deplânge Ben Goldacre. Un articol poate da într-adevăr frâu liber autorilor pentru a prezenta doar rezultatele care le convin sau într-o formă mai prietenoasă cu media și, prin urmare, părtinitoare.
Este, de asemenea, regretabil faptul că aceste eșecuri nu dau naștere niciunei sancțiuni: nici o structură nu a fost sancționată vreodată, suspină Ben Goldacre. „Cum se face că instituțiilor care nu și-au publicat niciodată rezultatele sunt încă autorizate să efectueze studii clinice? Și cum este faptul că sponsorii continuă să le finanțeze sau că comitetelor de etică nu le pasă? », Chiar se lasă scăpat de Sile Lane, al organizației de caritate britanice Sense about Science, care lucrează pentru buna informare a faptelor științifice. "Această lipsă de într-adevăr, atunci când frecvența unei unde care. "data-image =" https://cdn.futura-sciences.com/buildsv6/images/midioriginal/f/8/7/f87769a6ae_79977_transparent.jpg "data-url ="/sciences/definition/physique-transparent-1646/"data-more =" Read more "> transparența este o problemă reală, deoarece studiile clinice sunt folosite de medici, pacienți și autorități pentru a face alegeri în cunoștință de cauză", avertizează Ben Goldacre.
În Statele Unite, situația nu este mult mai bună. Rezultatele studiilor clinice trebuie publicate și pe platforma ClinicalTrials.gov, dar există multe excepții ale căror criterii sunt destul de vagi. Baza de date are prea multă prejudecată pentru a putea fi utilizată, potrivit Ben Goldacre și colegilor săi. Laboratorul său EBM DataLab a lansat totuși un site similar cu cel pentru Europa, FDAAA Trials Tracker. Rata de conformitate este de 59,4%, cu 10 puncte mai mult decât în Europa.
- Jumătate din rezultatele studiilor clinice efectuate în Europa nu sunt niciodată publicate în registrul oficial obligatoriu.
- Laboratoarele mari au o rată de conformitate aproape de 100%, dar instituțiile publice sunt mult mai puțin riguroase.
- Aceste încălcări nu sunt însă niciodată sancționate.
Studii clinice: cercetarea medicală are nevoie de noi
Articol de destinație Santé publicat în 29.04.2010
„Nu putem face fără teste la oameni”: acesta este un adevăr indubitabil al cercetării medicale. Cu toate acestea, există prea puțini voluntari, în special în Franța. O penurie dăunătoare care a determinat lansarea unei campanii majore de recrutare.
Centrul Național pentru Managementul Testelor Produselor de Sănătate (CENGEPS) lansează o campanie „pentru a mobiliza publicul larg în problema cercetării clinice”. Dincolo de informații, reprezentanții săi doresc mai presus de toate să îmbunătățească imaginea studiilor clinice cu publicul și să încurajeze toată lumea să se implice.
Potrivit unui sondaj publicat ca parte a acestei campanii, șase din zece francezi cred că studiile clinice sunt „riscante”. În cele din urmă, această teamă a determinat 54% dintre cei chestionați să nu „ia în considerare participarea la un proces personal”.
Campania CENGEPS se bazează în principal pe un nou portal de internet, Notre-recherche-clinique.fr. Progresul proceselor pas cu pas, aspecte, reglementări, compensare, mărturii ale participanților. acest site își propune mai ales să risipească îndoielile cu privire la acest subiect. „Nu putem face fără încercări umane”, explică Patrice Jaillon, președintele CENGEPS. Cu siguranță, se efectuează teste pe animale pentru a cunoaște efectele benefice și riscurile toxice, dar nu putem transpune apoi direct rezultatele de la animale la oameni. "
Încercări foarte supravegheate
În Franța, recrutarea voluntarilor pentru studii clinice este guvernată de legea Huriet-Sérusclat din 20 decembrie 1988. Îmbogățită de texte succesive (în special legea din 9 august 2004), garantează conduita etică a studiilor, care sunt de asemenea, monitorizat continuu de către autoritățile sanitare. Astfel, Agenția Franceză pentru Siguranța Produselor de Sănătate (Afssaps) este informată în mod sistematic cu privire la „efectele secundare grave și neașteptate” care pot fi legate de un medicament experimental. Astfel, poate lua orice decizie referitoare la acestea (interdicție, suspendare).
În cele din urmă, trebuie remarcat faptul că Ministerul Sănătății a pus online la sfârșitul anului 2006, așa-numitul site de referință pentru cercetarea biomedicală, a cărui ambiție a fost tocmai de a informa pacienții și profesioniștii despre cercetarea clinică. Din păcate, acest site nu pare să fi decolat niciodată. La patru ani de la crearea sa, zona Individuals este încă în construcție, la fel ca și motorul de căutare. În ceea ce privește ultimele știri, datează din. 27 august 2006.
- Nu, amenzile pentru nepurtarea unei măști nu sunt ilegale - Eliberare
- Adoptăm medicina chineză pentru o iarnă sănătoasă
- Sfaturile noastre pentru a ști dacă fructele de mare sunt proaspete Femme Actuelle The MAG
- Feriți-vă de aparențe dacă panda este atât de leneș, este doar pentru a supraviețui
- New Canada's Food Guide Produse lactate Nu mai este necesar pentru sănătate