3. Molecule de adeziune [biologie celulară]
Fibronectina și laminina
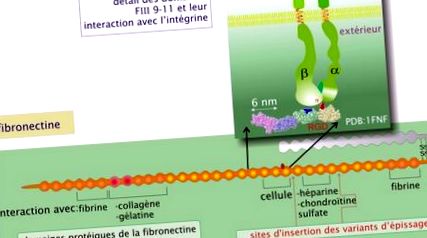
Fibronectina
Fibronectina ajută atât la organizarea matricei, cât și la promovarea aderenței celulelor la matricea extracelulară. Fibronectina, formată din două subunități \ (\ alpha \) și \ (\ beta \) (greutate moleculară aproximativ 230 kDa fiecare) unite de o pereche de punți disulfură, formează o rețea fibrilară. Datorită îmbinării alternative a ARNm, aceeași genă este sursa mai multor subunități. Proteina este în esență o combinație de trei tipuri de domenii (I, II, III) care se repetă de mai multe ori. Diferitele domenii se dezvoltă în site-uri de interacțiune specifice cu, pe de o parte, constituenții moleculari ai matricei extracelulare (formarea unui cadru) și, pe de altă parte, celulele (prin intermediul integrinelor). Un sit important pentru legarea integrinei este o secvență de trei aminoacizi, acidul arginină-glicină-aspartic (RGD) și se află în domeniul FIII 10.
Proteina este eliberată în mediul extracelular sub formă globulară solubilă. Contactul cu integrinele liniarizează molecula, care se poate asocia astfel cu omologii săi și cu alte componente ale matricei extracelulare. Fibronectina joacă un rol important în ghidarea celulelor în timpul migrațiilor embrionare la nivelul vertebrelor (gastrulație și migrarea celulelor neuronale ale crestei). Importanța fibronectinei este demonstrată în timpul transgenezei experimentale la șoareci: embrionii lipsiți de gena fibronectinei nu depășesc a noua zi embrionară din cauza unui deficit în dezvoltarea mezodermului, a tubului neural și a sângelui vaselor. La adulți, fibronectina joacă, de asemenea, un rol central în procesele de vindecare a rănilor.
Laminin
Laminina este un complex proteic mare, flexibil, format din trei lanțuri polipeptidice, \ (\ alfa \) (165 până la 200 kDa), \ (\ beta \) (140 kDa) și (105 până la 150 kDa). Au fost caracterizate douăsprezece forme diferite de laminină (\ (\ alpha \) 1-5, \ (\ beta \) 1-3 și \ (\ lambda \) 1-3), compunând astfel unsprezece proteine diferite (de exemplu, \ (\ alpha1 \ \ beta1 \ \ lambda1 \) sau \ (\ alpha2 \ \ beta1 \ \ lambda3 \) etc). Cele trei lanțuri formează o cruce asimetrică având mai multe site-uri de interacțiune cu celulele (prin intermediul integrinelor \ (\ alpha6 \ \ beta1 \) și \ (\ alpha6 \ \ beta4 \)) și cu celelalte componente ale matricei extracelulare (tip IV colagen și heparan sulfat). Laminina este constituentul esențial al laminei bazale.
Completa: Laminina și lamina bazală
În unele țesuturi, matricea extracelulară formează un strat subțire, compact și rezistent - lamina bazală. Se găsește la baza tuturor straturilor epiteliale și endoteliale, înconjoară celulele musculare, celulele grase, celulele Schwann (care formează teaca de mielină care înconjoară axonii celulelor nervoase periferice). Pe de altă parte, la fel ca în glomerul renal și alveola pulmonară, lamina bazală servește ca filtru molecular. Lamina bazală este produsă de celule care apoi se bazează pe ea. Este alcătuit din colagen de tip IV, laminină și proteoglicani. Colagenul de tip IV nu formează fibrile, ci formează o rețea.
Laminina și patologia
Laminina- \ (\ alpha2 \) este esențială pentru integritatea musculară. Într-adevăr, o mutație în subunitatea \ (\ alpha2 \), care are ca rezultat pierderea unei lamine bazale structurate, este responsabilă pentru distrofia musculară congenitală. Această afecțiune se datorează morții celulei musculare în urma absenței unui semnal de supraviețuire trimis de integrine (în special integrina \ (\ alpha7 \ \ beta1 \)) în interiorul celulei, atunci când acestea se leagă în mod specific cu laminina. Laminina- \ (\ alpha2 \) se găsește și în nervii periferici, care joacă un rol important în formarea tecii de mielină periaxonală. Deoarece este responsabil pentru mielinizarea defectă, absența lamininei \ (\ alpha2 \) determină pierderea stimulării musculare. La nivelul pielii, lamininele 5 (\ (\ alpha3 \ \ beta3 \ \ lambda2 \)) și 6 (\ (\ alpha3 \ \ beta1 \ \ lambda1 \)) contribuie la coeziunea dermică-epidermică, iar mutațiile acestor proteine favorizează apariția de vezicule (observate la pacienții cu epidermoliză buloasă joncțională).
- L; ideea de creare a; afacerea poate fi foarte simplă
- L; imaginea lui Stalin în plângerile rusești din secolul al XX-lea - Perseu
- L; impactul; Hrănindu-se cu comportamentul câinilor - Canidélite de Nature de Chien
- L; impactul suspendării contractului de muncă asupra sistemului complementar de protecție socială
- Hrănirea bebelușilor - Bebeluși și mame