Formarea ionilor
Capitolul 4: Electronii și nucleul atomului
1) Formarea ionilor din atomi
Atomii sunt compuși din electroni care se mișcă în jurul unui nucleu. În timpul anumitor fenomene (transformări chimice, frecare mecanică, expunere la radiații) atomul poate pierde unul sau mai mulți electroni.
Pierderea de electroni corespunde și unei pierderi de sarcini negative care duce la formarea unui compus încărcat electric: este un ion. Electronii pierduți de un atom nu pot subzista liber foarte mult timp și sunt capturați rapid de un alt atom care câștigă sarcini negative și își pierde și neutralitatea electrică, transformându-se, de asemenea, într-un ion.
Prin urmare, un ion poate fi format dintr-un atom care câștigă sau pierde unul sau mai mulți electroni.
- Se spune că astfel de ioni care se formează dintr-un singur atom sunt monoatomici.
- Numărul de electroni din jurul unui nucleu se poate schimba, dar nucleul nu este niciodată modificat și își păstrează numărul inițial de sarcini pozitive.
2) Formarea unui cation
Un cation fiind un ion pozitiv, este format dintr-un atom care pierde electroni.
Într-adevăr, după o pierdere de electroni, sarcinile negative devin mai puțin numeroase decât sarcinile pozitive.
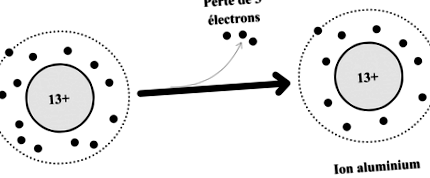
Exemplu de formare a ionului de aluminiu
Atomul de aluminiu este format din:
- din 13 electroni care transportă în total 13 sarcini negative.
- de 13 sarcini pozitive în nucleul său.
Acest atom poate pierde 3 electroni pentru a se transforma în ion de aluminiu care este apoi compus:
- de la 13 - 3 = 10 electroni care transportă în total 10 sarcini negative.
- 13 sarcini pozitive în nucleul său (nucleul nu este afectat de pierderea de electroni)
Dacă comparăm sarcinile pozitive și negative, observăm că ionul de aluminiu are 3 sarcini pozitive care depășesc sarcinile negative (13 sarcini + și 10 sarcini -).
Această sarcină în exces (numită și sarcină în exces) este notată cu un indicativ (sus în dreapta) în formula pentru ionul de aluminiu: Al 3+ .
Diagrama transformării atomului de aluminiu în ion de aluminiu
Notă
Formula pentru un ion este întotdeauna formată într-un mod similar. Folosim simbolul atomului din care este format ionul și apoi adăugăm la acesta expunând numărul și semnul exceselor de sarcini obținute prin compararea numărului de sarcini pozitive și numărul de sarcini negative.
3) Formarea unui anion
Un anion fiind un ion negativ, este format dintr-un atom care câștigă electroni.
Într-adevăr, după un câștig de electroni, sarcinile negative devin mai numeroase decât sarcinile pozitive.
Exemplu de formare a ionului clorură
Atomul de clor este format din:
- din 17 electroni care transportă în total 17 sarcini negative.
- de 17 sarcini pozitive în nucleul său.
Acest atom poate câștiga un electron pentru a se transforma într-un ion clorură care este apoi compus:
- 17 + 1 = 18 electroni care poartă un total de 18 sarcini negative.
- de 17 sarcini pozitive în nucleul său.
Dacă comparăm sarcinile pozitive și negative, observăm că ionul clorură are o sarcină negativă mai mare decât sarcinile pozitive (17 sarcini + și 18 sarcini -).
Formula pentru ionul clorură este deci: Cl - .
Diagrama transformării atomului de clor în ion clorură
4) Formula principalilor ioni
Iată formula chimică a principalilor ioni pe care trebuie să îi cunoașteți în clasa a III-a:
| n/A + | Cu 2+ | Cl - | Fe 2+ | Fe 3+ |
5) Ionii poliatomici
Ionii se pot forma și din seturi de mai mulți atomi care pierd sau câștigă unul sau mai mulți electroni. Acești ioni sunt numiți apoi ioni poliatomici (poli = mulți și atomici derivați din atom).
Exemple de ioni poliatomici
- Ion sulfat cu formula SO4 2-
- Ionul carbonat cu formula CO3 2-
- Activitatea fizică, o modalitate de mântuire în caz de supraponderalitate (severă) în timpul sarcinii Antrenament,
- Este cu adevărat obligatoriu instruirea în domeniul igienei restaurantelor; Știri Nutriție de calitate
- Instruire ACT L; Abordarea șamanică a terapiei
- Training - Conceptul Energy Slim
- Micro-nutriție; Organizație de formare profesională în fizioterapie