Microbiota și subnutriția: inventar
rezumat
Există un interes tot mai mare în analiza microbiotei intestinale. Acum este stabilit că un dezechilibru al microbiotei intestinale sau disbioză este implicat în mecanismele schimbărilor de greutate. Acest articol își propune să facă bilanțul cunoștințelor actuale dintre microbiota intestinală și subnutriție. Oamenii subnutriți au modificat diversitatea și abundența bacteriilor intestinale în comparație cu persoanele sănătoase. Primele studii privind modularea microbiotei intestinale de către probiotice, prebiotice, simbiotice, transplant fecal și antibiotice în scopul creșterii în greutate sunt încurajatoare. Cu toate acestea, multe studii sunt încă necesare înainte de orice implicație terapeutică.
Introducere
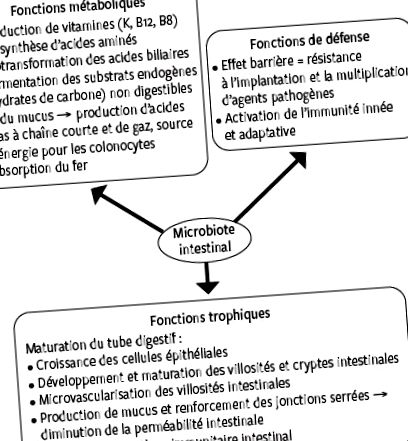
Microbiota intestinală este alcătuită din mai mult de 10 13 bacterii, aproximativ același număr de celule care alcătuiesc corpul uman. 1 Acesta corespunde tuturor microorganismelor tractului digestiv și îndeplinește trei funcții principale și esențiale: metabolice, trofice și de apărare (figura 1). 2 De-a lungul tractului digestiv, calitatea (diversitatea) și cantitatea (abundența) microbiotei variază. Abundența bacteriană maximă este atinsă în colonul distal cu 10 11 bacterii pe gram de scaun. 3 În ultimii ani, analiza compoziției și funcției microbiotei intestinale a crescut semnificativ în urma apariției unor noi tehnici de secvențiere a genomului bacterian. La om, microbiota intestinului colonului este dominată de două filuri bacteriene: Firmicutes (de exemplu, Clostridium) și Bacteroidetes (de exemplu, Bacteroides), urmate de Actinobacteria (de exemplu, Bifidobacterium), Proteobacteria (de exemplu, Escherichia) și Verrucomicrobia (de exemplu, Akkermansia) . Cu toate acestea, fiecare individ are propria sa microbiotă intestinală unică în ceea ce privește speciile bacteriene și proporțiile relative. 5
Funcțiile principale ale microbiotei intestinale
Un dezechilibru în microbiota intestinală se numește disbioză. Aceasta este o modificare a compoziției populațiilor bacteriene intestinale însoțită de o alterare calitativă (pierderea diversității) și/sau cantitativă (pierderea abundenței). O modificare a microbiotei intestinale ar putea fi astfel la originea variațiilor de greutate și, prin urmare, ar putea fi implicată în subnutriție.
Acest articol își propune să rezume cunoștințele actuale care leagă microbiota intestinală, subnutriția și cașexia, în principal la oameni. Din motive practice, vom folosi aici termenul de microbiotă intestinală. Cu toate acestea, de cele mai multe ori, analiza microbiotei se face în scaun și, prin urmare, este o reflectare a microbiotei fecale, care ar putea fi destul de diferită de cea prezentă în intestin sau în contact strâns cu membranele mucoase intestinale. Vom discuta 1) diferențele de microbiotă dintre persoanele sănătoase și subnutriți; 2) modularea microbiotei intestinale în scopul creșterii în greutate și a mușchilor; 3) diferitele metode de analiză a microbiotei și 4) perspectivele de viitor.
Diversitate, abundență a bacteriilor intestinale și subnutriție
Unele studii au arătat că microbiota intestinală este afectată la persoanele subnutrite (tabelul 1). Cu toate acestea, în prezent, rezultatele publicate sunt divergente și nu este clar dacă diferențele observate atunci când se compară persoanele subnutrate cu persoanele sănătoase sunt legate de subnutriția în sine sau de variațiile interindividuale.
Modificări ale microbiotei intestinale la persoanele subnutrite
Modularea microbiotei intestinale și creșterea în greutate
După cum vom vedea în acest capitol, câteva studii, efectuate în principal la copii cu SAM, au modulat microbiota intestinală prin probiotice, prebiotice, simbiotice, transplant fecal și antibiotice în scopul creșterii în greutate. Probioticele sunt microorganisme vii care, atunci când sunt ingerate în cantități suficiente, au un efect benefic asupra sănătății gazdei. Prebioticele sunt compuși alimentari nedigestibili care stimulează în mod selectiv creșterea și/sau activitatea anumitor bacterii intestinale, îmbunătățind astfel sănătatea gazdei. Simbioticele sunt o combinație de probiotice și prebiotice.
Subnutriție în rândul copiilor din țările în curs de dezvoltare
Probiotice, prebiotice și simbiotice
Un studiu clinic randomizat (studiu PRONUT) a evaluat eficacitatea clinică și nutrițională a unui amestec alimentar compus din patru bacterii probiotice (Pediococcus pentosaceus, Leuconosctoc mesenteroides, Lactobacillus paracasei, Lactobacillus plantarum) la o rată de 10 11 unități care formează colonii (CFU) și patru tipuri de prebiotice (inulină, pectină, tărâțe de ovăz, amidon rezistent) la copiii din Malawi. În vârstă de 5 până la 168 de luni (mediană de 22 de luni), au fost internați la spital pentru SAM (raport greutate-înălțime 10) Acest amestec, împreună cu alimente terapeutice gata de utilizat, cu conținut ridicat de calorii, a fost administrat copiilor din grupul de intervenție (n = 399) pentru o perioadă mediană de 33 de zile. Copiii din grupul de control (n = 396) au primit numai alimente terapeutice gata de utilizare. Nu s-a observat nicio diferență semnificativă între ambele grupuri cu privire la îmbunătățirea stării nutriționale, a mortalității, creșterea în greutate, timpul de vindecare sau prevalența simptomelor clinice precum diaree, febră sau probleme respiratorii.
Un alt studiu a fost efectuat pe șoareci gnotobiotici, adică șoareci lipsiți de microbiota la naștere, apoi colonizați artificial cu microbiota intestinală a sugarilor din Malawi cu vârsta de 6 luni și care prezintă o întârziere severă a creșterii (raportul de mărime).
Prin urmare, utilizarea probioticelor și prebioticelor în tratamentul malnutriției acute severe la copii rămâne controversată în acest moment.
Transplantul fecal
Pe scurt, transplantul de fecale poate prezenta un viitor tratament pentru SAM. Cu toate acestea, niciun studiu nu l-a evaluat încă la om pentru a trata subnutriția.
Antibiotice
Utilizarea antibioticelor la copiii cu SAM fără semne de infecție a fost deja descrisă în 1957 de un medic kenyan. Un tratament de 72 de ore cu aureomicină (o tetraciclină) versus placebo la 72 de copii a dus la o creștere de trei ori a creșterii în greutate zilnice. 14
Mai recent, la copiii din Malawi care suferă de SAM (raport greutate-înălțime 15
Antibioticele utilizate pentru tratarea SAM par a avea astfel beneficii asupra creșterii în greutate, probabil în legătură cu tratamentul sau prevenirea anumitor boli. Dar ar putea avea, de asemenea, un efect pozitiv asupra creșterii acestor copii prin reducerea disbiozei microbiotei intestinale, a inflamației sau chiar a permeabilității intestinale.
Cașexie sau malnutriție legată de boli
În ceea ce privește cașexia, din câte știm, nu există date disponibile în prezent la oameni. Prin urmare, vom aborda acest subiect prin studii la șoareci.
Probiotice, prebiotice și simbiotice
Pe scurt, mai multe modele animale demonstrează o alterare a microbiotei intestinale în bolile asociate cu cașexia, cum ar fi cancerul, bolile inflamatorii intestinale și sepsisul. Modularea microbiotei intestinale de către anumite probiotice sau simbiotice ar putea fi benefică pentru gazdă prin limitarea atrofiei musculare și a pierderii în greutate.
Mecanisme hipotetice care leagă microbiota intestinală și mușchiul
Au fost sugerate mai multe căi moleculare pentru conectarea microbiotei intestinale la mușchi. 19 Microbiota intestinală ar influența biodisponibilitatea serică a aminoacizilor, reglând astfel disponibilitatea acestora la nivel muscular. Dar ar putea afecta și masa musculară prin componentele bacteriene circulante (lipopolizaharide, peptidoglican, flagelină). În cele din urmă, microbiota intestinală ar putea avea, de asemenea, un impact asupra masei musculare prin modularea secreției citokinelor inflamatorii sau prin producerea anumitor metaboliți, cum ar fi acizii linoleici conjugați, acetat sau acizi biliari. Cu toate acestea, în prezent, ne lipsesc datele pentru a defini în mod clar mecanismele moleculare implicate în axa microbiotei intestinale-musculare.
figura 2 prezintă ipotezele actuale privind legătura dintre subnutriție, microbiota intestinală și bariera intestinală.
Ipotezele leagă subnutriția - microbiota intestinală - bariera intestinală
Analiza microbiotei intestinale și a perspectivelor de viitor
Metodele de analiză a microbiotei intestinale au evoluat rapid în ultimii ani. Abordarea clasică bazată pe cultură și teste suplimentare de genotipare/fenotipare și-a arătat limitele în studiul comunităților microbiene. Este laborioasă și costisitoare, dar și incompletă: aproximativ jumătate din speciile bacteriene din intestinul uman nu au fost niciodată cultivate în condiții de laborator. 20
Prin urmare, în anii 1980 au fost dezvoltate metode de analiză moleculară bazate pe amplificarea unei porțiuni de ARN ribozomal (ARNr) (abordare metaxonomică). Aceste metode s-au bazat mai întâi pe distincția produselor de amplificare PCR (reacție în lanț a polimerazei) în funcție de dimensiunea și caracteristicile lor fizico-chimice, apoi de secvența lor. De atunci, gena care codifică ARNr 16S a fost utilizată ca marker de alegere pentru identificarea filogenetică și taxonomică, adică pentru a identifica bacteriile și a le clasifica printre toate bacteriile cunoscute. Această genă își datorează succesul prezenței sale în toate procariotele, unei evoluții relativ lente și constante și structurii sale particulare. Este compus din domenii conservate între specii care permit amplificarea PCR cu „grunduri universale” și regiuni variabile (V1-V9) a căror succesiune permite identificarea taxonomică.
Ulterior, apariția secvențierii cu randament ridicat (Next Generation Sequencing, NGS) a făcut posibilă analiza compoziției comunităților microbiene a unui număr mare de probe în același timp (abordare metagenomică). Precizia acestor analize a fost îmbunătățită prin creșterea lungimii secvențelor analizate. De exemplu, lungimea secvențelor de ampliconi ale genei care codifică ARN ribozomal 16S, obținută pe un secvențiator de tip Illumina, a crescut de la 59 de nucleotide în 2009 21 la peste 500 de nucleotide astăzi. Prin urmare, o lectură mai completă a acestei gene face posibilă o mai precisă taxonomie. Alte tehnologii emergente de secvențiere permit obținerea unor secvențe chiar mai lungi, dar sunt puțin utilizate din cauza calității lor insuficiente (Nanopore) sau a costului lor mai mare (PacBio).
O altă abordare în caracterizarea comunităților bacteriene este secvențierea aleatorie a fragmentelor unui metagenom. Acest tip de analiză oferă informații taxonomice (listă de specii, genuri, familii și alte grupuri mai mari de bacterii) și informații funcționale (directorul proceselor în care sunt implicate genele acestor bacterii).
Recent, unele companii au oferit chiar și un serviciu personal de analiză metagenomică. Cu toate acestea, având în vedere cunoștințele actuale, este încă prea devreme să știm cum să interpretăm aceste rezultate și să aplicăm sfaturi nutriționale pentru a optimiza microbiota intestinală. Într-un cadru clinic, și până la apariția metodelor standardizate de analiză a microbiotei, o combinație de teste ar putea îmbunătăți validitatea concluziilor. În plus, sunt necesare cunoștințe mai bune despre microbiota intestinală și influența alimentelor asupra acestuia. Progresele în aceste domenii ar putea deschide calea pentru dezvoltarea unei medicamente și a unei nutriții personalizate, în special pentru a modula microbiota intestinală și a îmbunătăți starea nutrițională.
Concluzie
Microbiota intestinală este probabil implicată în procesul de subnutriție. Oamenii subnutriți au modificat diversitatea și abundența bacteriilor intestinale în comparație cu persoanele cu greutate normală și în stare bună de sănătate. Modularea microbiotei intestinale de către alimente, probiotice, prebiotice, transplant fecal sau chiar antibiotice ar putea constitui un nou mijloc terapeutic pentru prevenirea și tratamentul subnutriției. În prezent, și în special pentru cașexie, datele la om lipsesc, deși primele cercetări efectuate la șoareci sunt încurajatoare. Multe studii sunt încă necesare înainte de orice aplicare terapeutică. O definiție mai bună a microbiotei „optime”, potențial diferită între fiecare individ, pare esențială și trebuie confirmate primele ipoteze între legătura dintre subnutriție - microbiota intestinală - bariera intestinală, precum și identificarea biomarkerilor.
Conflicte de interes:
Autorii nu au declarat conflicte de interese în legătură cu acest articol.
implicatii practice
▪ Oamenii subnutriți au modificat diversitatea și abundența bacteriilor intestinale în comparație cu persoanele sănătoase
▪ Probiotice, prebiotice, simbiotice, transplant fecal și antibiotice ar putea reprezenta un tratament viitor pentru diferitele tipuri de malnutriție proteică-energetică
▪ În prezent, primele date la om, deși încurajatoare, lipsesc și multe studii sunt încă necesare înainte de orice implicație terapeutică
Bibliografie
Abstract
În prezent, există un interes crescut în rolul microbiotei intestinale în problemele de sănătate. Dovezile arată că un dezechilibru al microbiotei intestinale sau disbioză este implicat în mecanismele schimbărilor de greutate. Această revizuire vizează rezumarea cunoștințelor actuale dintre microbiota intestinală și malnutriție. Diversitatea și bogăția bacteriană intestinală sunt modificate la persoanele subnutrate în comparație cu persoanele sănătoase. Primele studii privind modularea microbiotei intestinale de către probiotice, prebiotice, simbiotice, transplant fecal și antibiotice pentru creșterea în greutate sunt încurajatoare. Cu toate acestea, sunt necesare studii suplimentare pentru a dezvolta și implementa un tratament eficient pentru malnutriție.
- Obezitatea infantilă care sunt riscurile pentru sănătate la vârsta adultă Swiss Medical Review
- Obezitate, tulburări de alimentație și grupuri de sprijin în adolescență - Swiss Medical Review
- Boli infecțioase - Revista medicală elvețiană
- Nutriție și fotbal - Swiss Medical Journal
- Mutațiile BRCA12 ale Angelinei Jolie în terapie - Swiss Medical Journal