Microhemoragii cerebrale subacute induse de injecția lipopolizaharidelor la șobolani
rezumat
Prezentăm un protocol pentru inducerea și detectarea MHC induse de injecția LPS la șobolanii Sprague-Dawley, care pot fi utilizate în cercetările viitoare privind patogeneza MHC.
Abstract
Microhemoragiile cerebrale (CMH) sunt frecvente la pacienții vârstnici și sunt corelate cu diverse tulburări neuropsihiatrice. Etiologia MHC este complexă și neuroinflamarea este adesea văzută ca o coincidență. Aici descriem un model subacut MHC de șobolani indus prin injecția de lipopolizaharidă (LPS), precum și o metodă de detectare a injecției sistemice de LPS MHC. este relativ simplu, economic și rentabil. Un avantaj major al injectării LPS este stabilitatea sa de a induce inflamația. MHC-urile induse prin injecția LPS ar putea fi detectate prin observare grosieră, colorare hematoxilină și eozină (HE), colorare prussiană Perl, colorare Evans albastră dublă (EB) și tehnologie de imagistică a senzitivității prin rezonanță magnetică (MRI-SWI). În cele din urmă, alte metode de dezvoltare a modelelor animale CMH, inclusiv avantajele sau dezavantajele acestora, sunt, de asemenea, discutate în acest raport.
Introducere
Microhemoragii cerebrale clasice (MHC) Vezi depozite mici perivasculare de produse de descompunere a sângelui precum hemosiderina din celulele roșii din sânge în creier 1. Conform studiului Rotterdam Scan, CMH-urile au fost găsite la aproape 17,8% dintre persoanele cu vârsta cuprinsă între 60 și 69 de ani și 38,3% la cei peste 80 de ani 2. Prevalența MHC la vârstnici este relativ ridicată și a fost stabilită o corelație între acumularea MHC și disfuncția cognitivă și neuropsihiatrică 3, 4. S-au raportat recent mai multe modele animale de MHC, inclusiv modele de rozătoare induse de injecția de colagenază stereotaxică de tip IV 5, APP transgenice 6, expunerea la β-N-metilamino-L-alanină, 7 și 8 de hipertensiune arterială, cu MHC induse de inflamația sistemică ca una dintre alegerile mai recunoscute. Fisher și colab. 9 au folosit mai întâi LPS derivat din Salmonella typhimurium pentru a dezvolta un model acut de șoarece MHC. Ulterior, același grup a raportat dezvoltarea unui model de șoarece MHC subacut folosind aceeași abordare 2 .
LPS este considerat a fi un stimul inflamator standardizat prin injecție intraperitoneală. Studiile anterioare au confirmat că injecția cu LPS ar putea provoca neuroinflamare, reflectată de cantitățile mari de celule microgliene și activarea astrocitelor la animalele model 2, 10. În plus, a fost stabilită o corelație pozitivă între activarea activării neuroinflamării și numărul de MHC2, 10. Pe baza acestor studii anterioare, am fost invitați să dezvoltăm un model de MHC de șobolan prin injecție intraperitoneală de LPS.
Progresele în tehnologiile de detectare au dus la o creștere a numărului de căutări pe MHC. Cele mai recunoscute metode de detectare a MHC includ detectarea celulelor roșii din sânge prin colorarea hematoxilinei și eozinei (HE), detectarea fierului feric din colorarea albastru prusian 9, detectarea depozitelor de albastru Evans prin imagistica imunofluorescentă (EB). Și imagistica prin rezonanță magnetică Tesla 7.0 -Imagistica ponderată pentru sensibilitate (IRM-SWI) 10. Prezentul studiu își propune să dezvolte o metodă de screening pentru MHC.
Abonament necesar. Vă rugăm să recomandați JoVE bibliotecarului dvs.
Protocol
Toate metodele descrise aici au fost aprobate de către Spitalul General al Armatei PLA și Comitetul pentru Utilizarea Animalelor (ACUC).
1. materiale
- Pregătirea pentru injecția LPS
- Se adaugă 25 ml apă distilată la 25 mg pulbere LPS derivată din Salmonella typhimurium, la o concentrație finală de 1 mg/ml. Păstrați injecția într-un tub steril la 4 ° C.
ATENȚIE: LPS este toxic. - Pregătiți o soluție de 2% EB în soluție salină normală 0,9% pentru a menține o injecție EB la concentrația de lucru.
- Se adaugă 25 ml apă distilată la 25 mg pulbere LPS derivată din Salmonella typhimurium, la o concentrație finală de 1 mg/ml. Păstrați injecția într-un tub steril la 4 ° C.
- Administrați LPS la șobolani Sprague-Dawley (SD) masculi în vârstă de 10 săptămâni (greutate medie: 280 ± 20 g) prin injecție intraperitoneală.
ATENȚIE: Dacă șobolanii sunt cumpărați de la o altă organizație, atunci faza de adaptare nu trebuie să fie mai mică de 7 zile.
3. Injecții LPS
- Injectați LPS intraperitoneal toți șobolanii la o doză de 1 mg/kg și readuceți șobolanii în cușca lor de acasă.
Notă: Anestezia nu este necesară. - Șase ore mai târziu, injectați aceeași doză de injecție de LPS la șobolani.
- Șaisprezece ore mai târziu injectați aceeași doză de LPS șobolanilor.
ATENȚIE: Injecția șobolanilor SD cu LPS la o doză de 1 mg/kg poate duce la o rată a mortalității de 5%. Rata mortalității ar putea crește în continuare la șobolanii mai tineri sau mai în vârstă sau la șobolanii gravide. - Întoarceți șobolanii în cuștile lor după injectarea LPS și oferiți acces la alimente și băuturi ad libitum .
NOTĂ: Șobolanii vor prezenta un răspuns inflamator sistemic distinct și, prin urmare, este esențial ca cuștile să rămână curate pe tot parcursul experimentului. Șobolanul trebuie monitorizat frecvent (2 ori pe zi) pentru greutate, aspect general și atitudine după prima injecție cu LPS. Dacă șobolanii încep să prezinte o postură încordată, reticența în a se mișca, pierderea semnificativă în greutate (> 20%), colorarea porfirinei au fost eutanasiați uman înainte de ziua 7 a studiului final al EB.
4. proba
5. are colorare
Notă: Această procedură se efectuează folosind un kit de colorare a ochilor.
- Spălați lamele în apă distilată.
- Se colorează în soluția de hematoxilină timp de 8 min. se spală în apă curentă timp de 5 min.
- Diferențiați în alcool acid 1% timp de 30 de secunde. se spală în apă curentă 1 min.
- Detergent de pete la 0,2% apă amoniacală (albire) sau soluție saturată de carbonat de litiu timp de 30 s până la 1 min. se spală în apă curentă timp de 5 min.
- Clătiți cu alcool 95% (10 picături).
- Contrastează cu soluție de eozină timp de 30 s până la 1 min.
- Deshidratați cu 95% alcool, două modificări de alcool absolut, câte 5 minute fiecare.
- Se curăță în xilen timp de 30 de secunde.
- Urcați folosind metoda lui Liu 9 .
- Analizați folosind un microscop cu fluorescență în câmp luminos.
NOTĂ: celulele roșii din sânge, eliberate de vasele de sânge, care constituie componentele MHC, sunt prezentate în colorare roșu-portocalie sub.
6. Culoarea Perl albastru prusac
Notă: Această procedură se efectuează utilizând un kit de colorare Perls.
- Diapozitive cu apă distilată.
- Colorare în soluție de reacție amestecând părți egale de ferocianură și acid clorhidric timp de 10 minute.
- Deshidratați, ștergeți, editați și analizați diapozitivele așa cum este descris la punctele 5.7 - 5.10.
7. Dublă colorare EB
Notă: Această procedură urmează pasul 4.1.3.
- Diapozitive cu PBS de trei ori de câte 5 minute fiecare.
- Incubați lamele cu soluție de 4 ', 6-diamidino-2-fenilindol (DAPI) timp de 15 minute la temperatura camerei.
- Se spală lamele cu soluție de PBS de trei ori timp de 5 min fiecare și montează lamele cu soluție de PBS-glicerol.
- Analizați imaginile pe un microscop cu fluorescență. Depozitele EB sunt indicate prin fluorescență roșie; nucleii sunt indicați prin fluorescență albastră.
- Efectuați RMN pe un magnet 7-T echipat cu un sistem de gradient ecranat activ (diametru interior 16 cm).
- La șapte zile după tratament, anesteziați șobolanii prin inhalarea unei măști de izofluran 1,5 până la 2,0%, utilizând un sistem de anestezie cu izofluran.
- Unguent veterinar pe ochi de șobolan pentru a preveni uscăciunea în timpul anesteziei.
- Păstrați șobolanii în decubit dorsal și efectuați scanarea MRI-SWI.
- Obțineți scanări SWI ponderate utilizând o secvență de ecou de rotire rapidă utilizând următorii parametri: timp de ecou (TE) 8 ms, timp de repetare (TR) 40 ms, unghi de răsucire = 12 °, câmp vizual (FOV) 35 mm × 35 mm, achiziție matrice 384 × 384, pentru a dobândi felii groase de 1 mm.
- Identificați MHC în RMN-SWI conform Greenberg și colab. 11, care a inclus următoarele criterii: (1) diametru ≤ 10 mm și pete de intensitate (2) semnal circular, izolat și slab.
- La sfârșitul experimentului, eutanasiați șobolanii folosind metoda dioxidului de carbon (un debit de 6 L/min) sau 30% din volumul care conține supradozaj.
Abonament necesar. Vă rugăm să recomandați JoVE bibliotecarului dvs.
Rezultate reprezentative
MHC-urile pot fi detectate folosind diverse abordări. Cele mai recunoscute metode sunt următoarele: (1) observarea și evaluarea grosieră a suprafețelor CMH (prezentate în Figura 1, panoul de sus); (2) are o colorare pentru detectarea celulelor roșii din sânge (prezentată în Figura 2a, panoul superior) sau detectarea derivată a colorării ferice prusiene a lizei celulelor roșii din sânge (Figura 2A, panoul inferior); (3) EB colorat pentru detectarea depozitelor EB din scurgeri BBB (Figura 3, panoul lateral stâng); (4) detectarea semnalelor hipointense CMH MRI-SWI (Figura 4), panoul din stânga).
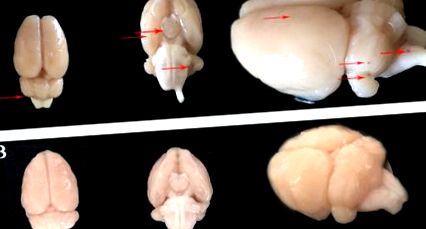
Figura 1: observarea grosieră a suprafețelor CMH. Panoul de sus (LA): Model de șobolan; Panoul inferior (B): animal de control. Săgețile roșii înseamnă suprafața CMH-urilor. modificat și reutilizat cu permisiunea de la 10. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 2: imagini de colorare și colorare prusiană. Model de șobolan (LA) reflexiv. Celulele roșii din sânge au fost găsite în afara capilarelor din panoul superior și punctele de fier feric din liza celulelor roșii din sânge au fost detectate în panoul inferior; (B) un control atent al animalelor. S-au găsit celule roșii din sânge și puncte de fier feric. Barele de scalare = 100 µm (panoul din stânga al A și B). Barele de scalare = 50 µm (panoul din dreapta al lui A și B). Autorizația a fost modificată și reutilizată cu 10. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 3. Imagistica cu fluorescență dublă a depozitelor de EB. Panoul din stânga: model de șobolan. Cantitatea de molecule EB a scăpat de BBB rănit au fost detectate (în roșu); Panoul din dreapta: animal de control. Nu au fost detectate molecule EB. DAPI în albastru a fost folosit ca suport de montare. Barele de scalare = 100 µm. modificat și reutilizat cu permisiunea de la 10. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Figura 4. Imagini ale RMN-SWI. Panoul din stânga (LA): Model de șobolan. Săgețile negre semnifică semnale hipointense de la MHC; Panoul din dreapta (B): animal de control. Nu a fost găsit niciun semnal hipointens. Autorizația a fost modificată și reutilizată cu 10. Faceți clic aici pentru a vizualiza o versiune mai mare a acestei figuri.
Abonament necesar. Vă rugăm să recomandați JoVE bibliotecarului dvs.
Discuţie
Studiile de cercetare privind CMH au crescut în ultimii ani. Cu toate acestea, mecanismul MHC rămâne neclar, determinând cercetătorii să stabilească modele animale care imită această afecțiune specială. De exemplu, Hoffmann și colab. a dezvoltat un model de șoarece MHC indus de hipoxie care arată că MHC sunt cauzate de hipoxie și perturbarea autoreglării cerebrovasculare 12. Reuter și colab. 5 au stabilit un model MHC la șoarecii transgenici APP23, care prezentau angiopatie amiloidă pliabilă (CAA), un rol important în etiologia MHC. Fisher și colab., a raportat un model de șoarece MHC care a fost indus de injecția LPS 9, care a dezvăluit că MHC sunt cauzate de inflamația 2, 13, 14. De asemenea, am dezvoltat cu succes un model MHC subacut la șobolani SD folosind injecție LPS și am constatat că oxidul nitric sintază (NOS), în special neuroni NOS și NOS endotelial, sunt implicați în MHC etiologice, provocând inflamații 10 .
Pasul critic al protocolului nostru este injectarea LPS, care a fost utilizată pe scară largă în dezvoltarea modelelor de șoarece de tulburări neuropsihiatrice, cum ar fi depresia, 15, 16 ale schizofreniei, 17 boala Parkinson, 17 boala Alzheimer 18 și 19 boala prionică. Din câte știm, utilizarea unei doze unice (1 mg/kg) este mult mai mare decât cea aplicată în celelalte studii 15, 16, 17, 18, 19. Acesta ar putea fi un motiv plauzibil al mortalității în prezentul studiu. Modificarea dozei de LPS pentru inducerea MHC poate fi un subiect interesant de cercetare, deoarece diferite doze sau injecții ar fi trebuit să fie dezvăluite pentru a influența numărul, dimensiunea, distribuția și progresia MHC 2. Un studiu anterior a arătat că administrarea de LPS la o doză de 3 mg/kg la șoareci a indus MHC acut 2 .
Deși dezvoltarea diferitelor modele animale a facilitat cercetarea asupra MHC-urilor, trebuie să admitem că aceste modele animale nu simulează procesul MHC-urilor clinice. De exemplu, în modelul nostru de șobolan, la fel ca modelul șoarecelui Fisher, MHC au fost observate în cerebel, dar cele mai multe au fost observate în regiunile lobare (în principal legate de CAA) și în locațiile adânci sau infra-tentoriale (în principal hipertensiune arterială) 20, 21. nu avem nicio explicație pentru această discrepanță în distribuție, deși Fisher și echipa noastră atribuie această observație vulnerabilității vaselor de sânge cerebelului la inflamație.
În mai multe cazuri clinice, MHC rezultă din mai mult de un factor etiologic, deși inflamația joacă un rol important în etiologia sa. Studiile care examinează mai mulți factori care induc MHC, în loc de MHC pure induse de inflamație, pot fi astfel mai utile în simularea acestei afecțiuni. Modelul de injecție LPS ar putea fi utilizat de alți factori de bază pentru a examina mecanismul MHC. De exemplu, Fisher și colab. a efectuat un pas preliminar, încă interesant, cu șoareci îmbătrâniți injectați cu LPS și a demonstrat că îmbătrânirea este un factor cheie care ar putea face creierul mai susceptibil de a fi indus de inflamația MHC 14. În opinia noastră, importanța prezentului model este compatibilitatea sa cu alți factori din modelele animale pentru îmbătrânirea 14, traumatismul 22, precum și bolile cronice precum hipercolesterolemia 23 sau modelele transgenice precum hipertensiunea arterială.24 datorită simplității, timpului -eficiența și stabilitatea acestui protocol.
Pacienții cu MHC prezintă declin cognitiv, manifestări neuropsihiatrice și amețeli, care sunt asociate cu distribuția MHC. Una dintre limitările acestui protocol este că, după injectarea LPS, nu am putut exclude efectele inflamației periferice asupra comportamentului șobolanilor, deși o scădere a comportamentului social și de vizuină (activitatea intrinsecă a rozătoarelor naturale care reflectă deprecierea activităților zilnice) au fost observat. În plus față de studiile privind modalitățile de îmbunătățire a metodei noastre de generare a unui model animal MHC, de exemplu, metoda de injectare LPS sau anexa de observare, sunt garantate.
Cu toate acestea, acest model de MHC murin simplu, rentabil și stabil indus de injecția cu LPS poate fi utilizat de cercetători în elucidarea etiologiei MHC-urilor.
Abonament necesar. Vă rugăm să recomandați JoVE bibliotecarului dvs.
- Descoperirea topografiei circuitelor neuronale în protocol multicolor (tradus în franceză)
- Salva Pear Clisma cu injecție dublă - Paraphamadirect
- Revitalizarea fără ac sau injecție
- Injecție cu steroizi anabolizanți; Profesori catolici din Waterloo
- Construiți înainte de l; Vara în 10 minute pe zi Slăbire și armonie